研究紹介
機能性糖誘導体
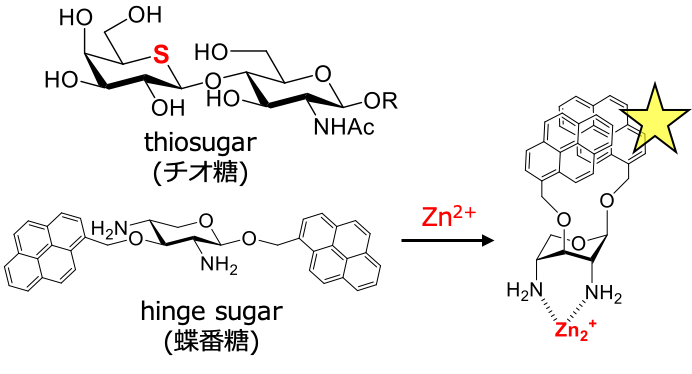
私たちの研究室では、これまで多数の機能性糖化合物を開発してきました。例えば、環内の酸素原子を硫黄原子に置換したチオ糖は、糖の構造や認識能を保ったまま、高い阻害活性を有することを見出しました。この知見は、上市されている糖尿病治療薬に活かされています(糖尿病治療薬開発秘話、蔵前ゼミ印象記)。
また、キシロピラノース誘導体の環反転特性を活用し、金属イオンに応答して蝶番のような動きをする分子デバイス”蝶番糖”を開発しました。
Org. Lett. 2004, 6, 1489–1492.
Curr. Top. Med. Chem. 2009, 9, 76-86.
Chem. Asian J. 2015, 10, 586-594.
アップコンバージョン発光を利用した光線力学治療法
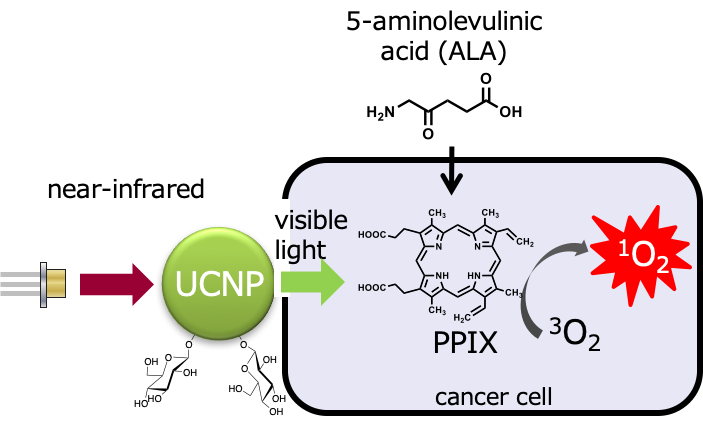
非侵襲ながんの治療法として、光と光増感剤を用いる光線力学治療法が開発されており、現在ではクリニックで治療を受けることが可能になっています。しかし、光線力学治療には現在でもいつくか課題があり、その一つに現在用いられている光の組織深達性の低さが挙げられます。この課題解決のため、私たちは組織深達性のより高い近赤外光の利用を考えました。そこで、近赤外光を可視光に変換できるアップコンバージョンナノ粒子(UCNP)を利用した光線力学治療法の開発を行っています。
Photodiagnosis Photodyn. Ther. 2013, 10, 607-614.
Int. J. Mol. Sci. 2015, 16, 22415-22424.
Bioorg. Med. Chem. 2017, 25, 743-749.
特許第5854407号
室温燐光物質の発見と発光機構解明
私たちは、イソフタル酸などの簡単な構造の有機化合物の結晶が、室温で燐光を示すことを初めて見出しました。これらの結晶の発光機構を詳細に調べたところ、光励起によって電荷分離状態になった後に、超微細結合(HFC)によって項間交差していることを示す結果を得ました。ここで見出した項間交差促進機構に関する知見を活用して、独自の光増感剤開発を進めています。
Phys. Chem. Chem. Phys., 2015, 17, 15989-15995.
ChemPhotoChem, 2017, 1, 102-106.
Bull. Chem. Soc. Jpn. 2018, 21, 223-229.

小さな高効率光増感剤
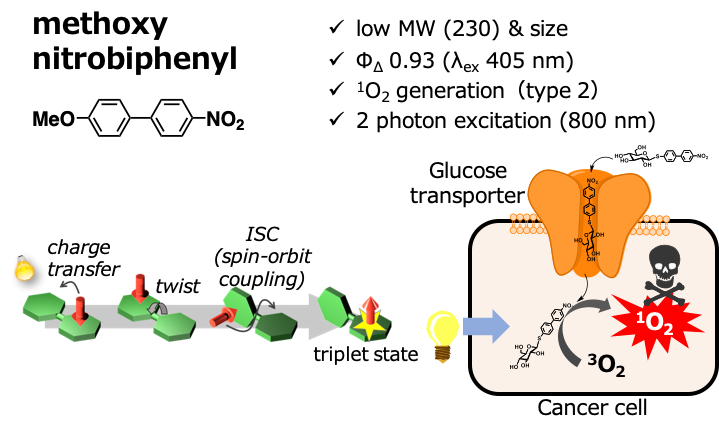
光を用いる非侵襲ながんの治療法、光線力学治療法において、現在では光増感剤としてレザフィリンに代表される大環状芳香族化合物が市販薬として用いられています。しかし、がん細胞への集積性の課題や、比較的分子量が大きいことから体外への排出に時間がかかり、光過敏症などの副作用を避けるため2週間程度の遮光が推奨されるなど、課題も残されています。
そこで私たちは、独自の分子設計に基づいた小型高効率光増感剤の開発を行なっています。さらに、グルコースとのコンジュゲートにより、がんで高発現するグルコーストランスポーターを介したがん細胞への取り込みを達成しています。
J. Org. Chem. 2018, 83, 13765-13775.
Chem. Asian J. 2019, 14, 2067-2071.
Bioorg. Med. Chem., 2022, 116737. (highlighted on front cover)
特願2016-102568
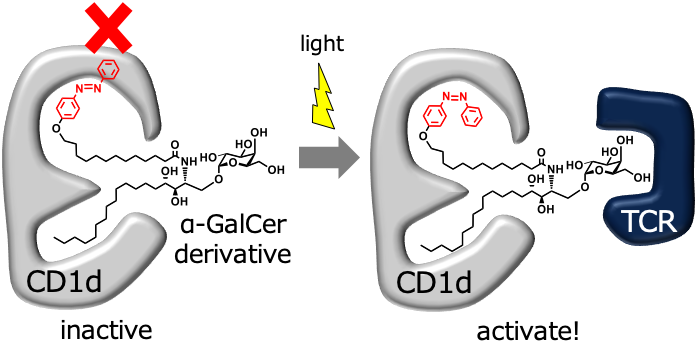
光免疫治療を指向した光応答性糖脂質
第4のがん治療法としてがん免疫療法が注目されています。なかでもα-GalCer(α-ガラクトシルセラミド)という糖脂質は、CD1dタンパクと結合し免疫細胞であるNKT細胞を活性化し免疫を活性化します。α-GalCerを用いたがん治療薬開発が進んでいましたが、繰り返し投与すると免疫応答が起こらなくなることが明らかになりました。この原因の一つとしてα-GalCerが体内で長期間作用することが考えられます。
そこで私たちは、光によって構造が変化するα-GalCer誘導体を設計・合成し、光照射部位で局所的に免疫を活性化できる分子の開発を行っています。
Bioorg. Med. Chem. Lett. 2020, 30, 126960.
特願2019-178451
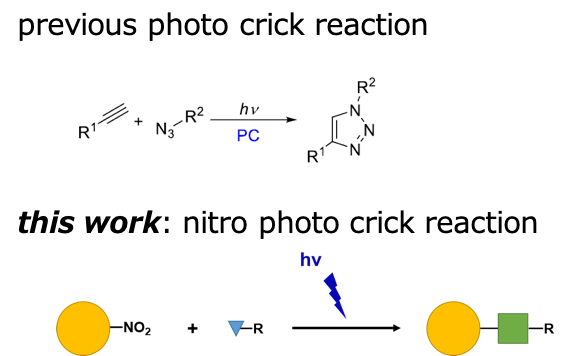
新しい光クリック反応
私たちの開発した光増感剤を用いた反応の副反応の中から、本来化学的に安定な芳香族ニトロ基が、光によって特異的に新しい結合を形成する反応(光クリック反応)を見出しました。
ニトロ基を基質とした光クリック反応はこれまでに報告されておらず、時空間選択的なラベル化反応や、医薬品合成における合成終盤での多種類置換基の導入などの応用が期待されます。
特願2021-206935
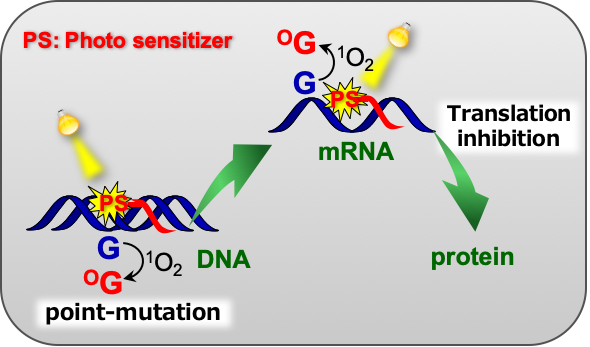
光増感剤を用いた光遺伝子制御法
一重項酸素(1O2)は、トリプトファン、チロシン、脂質の不飽和結合、グアニン塩基などの生体分子を選択的に酸化します。なかでも核酸のグアニン塩基の酸化は、遺伝子の変異や損傷の原因になるため注目されています。1O2はグアニン塩基と衝突して酸化しますが、DNAからどの程度離れた1O2が酸化し得るのかといった基本的な知見はまだ正確には明らかになっていません。そこで、私たちの開発した小さな1O2生成剤(光増感剤)を活用して、DNAのような微小環境での1O2の酸化特性を研究しています。
これらの知見を用いて、DNAやRNAの意図した部位への酸化による変異導入や不活性化による光遺伝子制御法の開発を行っています。
特願2021-140194
AMED先端的バイオ創薬等基盤技術開発事業:生細胞内セントラルドグマ分子の光操作
https://bio-med.jp/projects/yuasa/
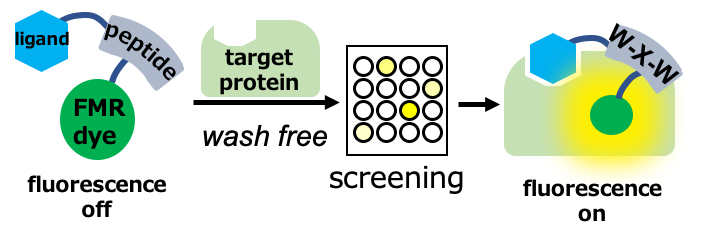
turn-on型蛍光プローブ
生細胞イメージング等において、洗浄なしで標的タンパク質を特異的に蛍光検出できるturn-on型蛍光プローブ開発が行われています。このような特異な性質を示す蛍光分子として、励起状態の分子内回転が抑制された際に蛍光を示す蛍光性分子ローター(FMR)の研究が進んでいますが、FMRの動きを強固に固定する必要があり、これまでは標的にできるタンパク質の構造が限定的でした。そこで私たちは、様々な標的タンパク質へ適用可能な蛍光プローブ開発を目指し、高い蛍光応答性を示すFMRの開発や、FMRプローブライブラリーの探索法を開発しています。